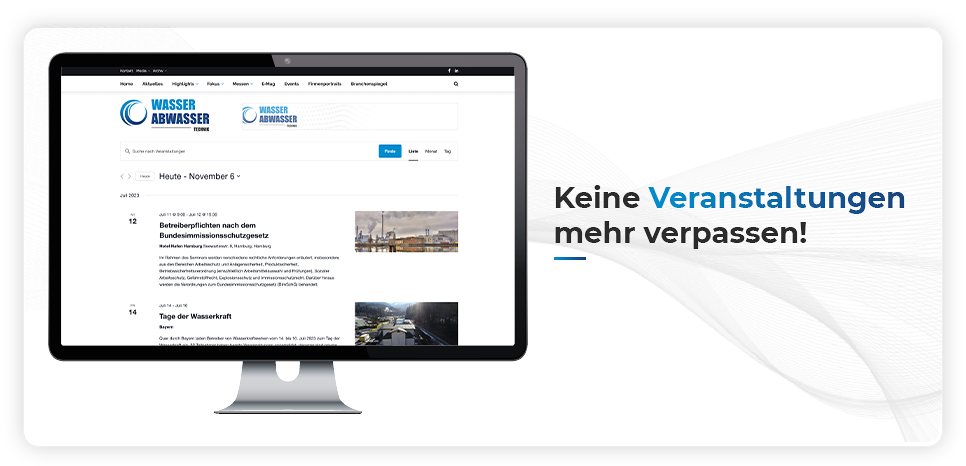
Analyten-Konzentration in Probenlösung bestimmen
Container for the scroll indicator
(Will be hidden in the published article)
Titrant-Standardisierung
Zuerst muss das Titriermittel standardisiert werden. Dieser Schritt liefert die genaue Konzentration der Titrierlösung und erhöht die Genauigkeit des Ergebnisses.
Probenvorbereitung
Für die Titration müssen die Proben in Lösung sein. Daher werden feste Proben aufgelöst oder vorbehandelt, um den Analyten freizugeben (z. B. durch Aufschluss, Extraktion oder Veraschung).
Manchmal müssen Hilfslösungen hinzugefügt werden. Beispielsweise müssen Redoxtitrationen oft bei einem bestimmten pH-Wert durchgeführt werden. Indirekte Titrationen benötigen immer eine Hilfslösung, da der Analyt in eine reaktive Form überführt werden muss. Diese reaktive Form wird dann titriert.
Bei Rücktitrationen (oder Resttitrationen) wird zunächst ein Überschuss eines Reagenzes hinzugefügt. Dieses Reagenz reagiert mit dem Analyten und sein Überschuss wird dann titriert.
Berechnung des Ergebnisses
Nach der Titration wird das Ergebnis berechnet. Automatische Titratoren berechnen das Ergebnis selbst. Für die Berechnung der Analytkonzentration werden folgende Variablen benötigt: Probengrösse (entweder das Probengewicht oder das Probenvolumen), Titrantkonzentration, üblicherweise in mol/L, Titer (Korrekturfaktor für Titrant), Titrationsvolumen bis zum Endpunkt, in ml, Stöchiometrischer Faktor für die Reaktion zwischen Analyt und Titrant.
Arten der Titration
Titrationen können auf unterschiedliche Weise klassifiziert werden. Eine ist die Endpunkterkennungsmethode, jedoch werden sie am häufigsten nach der verwendeten chemischen Reaktion klassifiziert.
Redoxtitrationen
Diese Titration basiert auf einer Redoxreaktion zwischen Analyten und dem Titranten. Das Titrationsmittel ist ein Reduktionsmittel oder Oxidationsmittel. Gängige Beispiele sind Iodometrie, Permanganometrie und Cerimetrie. Auch Karl-Fischer-Titrationen fallen in die Kategorie der Redoxtitrationen. Zur Anzeige des Endpunktes werden Metallelektroden verwendet.
Fällungstitrationen
Bei dieser Titrationsmethode bilden Analyt und Titrant ein unlösliches Salz. Ein häufiges Beispiel ist die Argentometrie. Auch die Titration von Tensiden fällt in diese Kategorie. Zur Anzeige des Endpunktes werden Metallelektroden oder ionenselektive Elektroden verwendet.